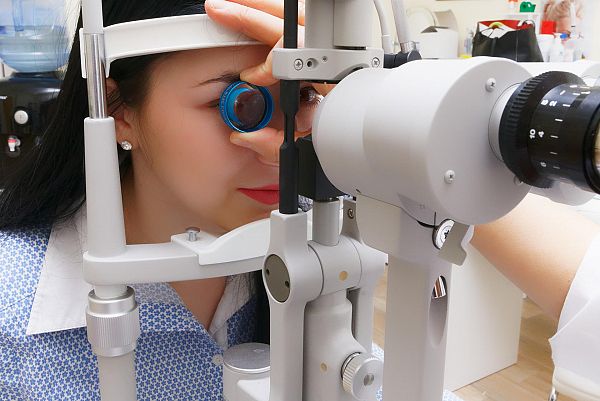
Комитетът по лекарствените продукти в хуманната медицина на Европейската агенция по лекарствата (CHMP) прие положително становище и препоръча издаване на разрешение за употреба на лекарствения продукт Vabysmo, предназначен за лечение на неоваскуларна макулна дегенерация (nAMD) свързана с възрастта, и диабетен макулен едем (DME).
Препаратът е създаден и се произвежда от Roche Registration. Vabysmo ще се предлага като инжекционен разтвор от 120 mg/ml. Активното вещество на е фарицимаб - биспецифично антитяло, което неутрализира както ангиопоетин-2 (Ang-2), така и VEGF-A.
Чрез двойно инхибиране на Ang-2 и VEGF-A, фарицимаб намалява съдовата пропускливост и възпалението, инхибира патологичната ангиогенеза и възстановява съдовата стабилност, които са свързани с увеличената дебелина на ретината, наблюдавана при двете заболявания - nAMD и DME.
Основната полза от Vabysmo се изразява в подобряване на зрителната острота, а най-честите нежелани реакции са катаракта и конюнктивален кръвоизлив.
Пълната индикация, утвърдена от регулатора е: Лечение на възрастни пациенти с неоваскуларна (влажна) свързана с възрастта дегенерация на макулата (nAMD), Зрително увреждане поради диабетен макулен едем (DME).
Vabysmo трябва да се прилага от квалифициран лекар с опит в интравитреалните инжекции, обръщат внимание от ЕMA.